
Vì vậy, đây là danh sách dưới đây bạn sẽ thấy các tài liệu bắt buộc. Nhưng cũng nên lưu ý rằng tài liệu QMS (Hệ thống Quản lý Chất lượng) bao gồm không chỉ các tài liệu bắt buộc mà còn các tài liệu khác được quy định bởi các yêu cầu quy định hiện hành.
HỒ SƠ VÀ CÁC QUY TRÌNH ISO 13485
Dưới đây là các hồ sơ và các quy trình iso 13485 cần thiết để tuân thủ ISO 13485: 2016.
(Xin lưu ý rằng một số tài liệu sẽ không bắt buộc nếu công ty không thực hiện các quá trình có liên quan):
Vai trò được thực hiện bởi tổ chức theo các yêu cầu quy định pháp luật hiện hành (mục 4.1.1)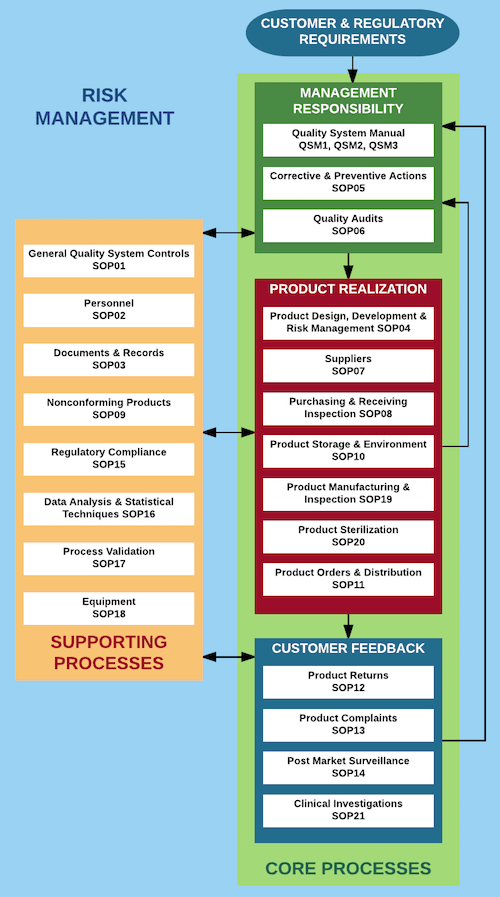
Thủ tục và hồ sơ xác nhận giá trị sử dụng việc áp dụng phần mềm máy tính (mục 4.1.6)
Sổ tay Chất lượng (mục 4.2.2)
Hồ sơ thiết bị y tế (mục 4.2.3)
Thủ tục kiểm soát tài liệu (mục 4.2.4)
Thủ tục kiểm soát hồ sơ (mục 4.2.5)
Chính sách chất lượng (khoản 5.3)
Mục tiêu chất lượng (mục 5.4.1)
Trách nhiệm và quyền hạn (mục 5.5.1)
Thủ tục và hồ sơ để xem xét của lãnh đạo (mục 5.6.1)
Thủ tục đào tạo (mục 6.2)
Yêu cầu về cơ sở hạ tầng và các hoạt động bảo trì (mục 6.3)
Yêu cầu đối với môi trường làm việc (mục 6.4.1)
Sắp xếp để kiểm soát các sản phẩm bị ô nhiễm hoặc có khả năng bị ô nhiễm (mục 6.4.2)
Quy trình quản lý rủi ro trong quá trình thực hiện sản phẩm (khoản 7.1)
Đầu ra của kế hoạch thực hiện sản phẩm (khoản 7.1)
Hồ sơ của kết quả xem xét yêu cầu của khách hàng và hành động phát sinh từ nó (mục 7.2.2)
Hồ sơ liên lạc với khách hàng (mục 7.2.3)
Quy trình ISO 13485 về thiết kế phát triển
Thủ tục thiết kế và phát triển (mục 7.3.1)
Kế hoạch thiết kế và phát triển (mục 7.3.2)
Đầu ra thiết kế và phát triển (mục 7.3.4)
Hồ sơ xem xét thiết kế và phát triển (mục 7.3.5)
Kế hoạch, kết quả và kết luận về kiểm tra xác nhận thiết kế (mục 7.3.6)
Thủ tục chuyển giao kết quả thiết kế và phát triển sản xuất (mục 7.3.8)
Quy trình và hồ sơ kiểm soát sự thay đổi thiết kế và phát triển (mục 7.3.9)
Hồ sơ thiết kế và phát triển (mục 7.3.10)
Quy trình ISO 13485 về mua hàng và quản lý nhà cung cấp
Thủ tục mua hàng (mục 7.4.1)
Các tiêu chí và hồ sơ đánh giá và lựa chọn nhà cung cấp (mục 7.4.1)
Bản kiểm tra sản phẩm đã mua (mục 7.4.3)
Hồ sơ truy xuất nguồn gốc cho mỗi thiết bị y tế hoặc lô hàng (mục 7.5.1)
Quy trình ISO 13485 về độ sạch và khử trùng sản phẩm
Yêu cầu về độ sạch của sản phẩm (mục 7.5.2)
Yêu cầu về tiêu chuẩn lắp đặt và chấp nhận để xác minh việc lắp đặt thiết bị y tế (mục 7.5.3)
Hồ sơ lắp đặt thiết bị y tế và thẩm định lắp đặt (mục 7.5.3)
Thủ tục và hồ sơ dịch vụ thiết bị y tế (mục 7.5.4)
Hồ sơ về quá trình khử trùng (mục 7.5.5)
Thủ tục và hồ sơ xác nhận quá trình sản xuất và cung cấp dịch vụ (mục 7.5.6)
Quy trình và hồ sơ xác nhận quá trình khử trùng và các hệ thống rào vô trùng (mục 7.5.7)
Quy trình ISO 13485 về nhận dạng và truy suất nguồn gốc
Thủ tục nhận dạng sản phẩm (mục 7.5.8)
Thủ tục truy xuất nguồn gốc (mục 7.5.9.1)
Hồ sơ truy xuất nguồn gốc, tên và địa chỉ của bên nhận vận chuyển (khoản 7.5.9.2)
Báo cáo về những thay đổi về tài sản của khách hàng (mục 7.5.10)
Thủ tục đảm bảo sự phù hợp của sản phẩm (mục 7.5.11)
Thủ tục theo dõi và đo lường (mục 7.6)
Biên bản hiệu chuẩn (mục 7.6)
Thủ tục và hồ sơ xác nhận việc áp dụng phần mềm máy tính dùng để giám sát và đo lường (mục 7.6)
Quy trình ISO 13485 về thông tin khách hàng và đánh giá nội bộ
Thủ tục phản hồi của khách hàng (mục 8.2.1)
Thủ tục và hồ sơ xử lý khiếu nại (mục 8.2.2)
Hồ sơ báo cáo cho cơ quan quản lý (mục 8.2.3)
Thủ tục đánh giá nội bộ (mục 8.2.4)
Biên bản đánh giá nội bộ và kết quả (mục 8.2.4)
Thông tin nhận dạng của người có thẩm quyền thông qua sản phẩm (mục 8.2.6)
Quy trình ISO 13485 về kiểm soát sản phẩm không phù hợp
Thủ tục và hồ sơ kiểm soát sản phẩm không phù hợp (mục 8.3.1)
Biên bản làm lại (khoản 8.3.4)
Quy trình ISO 13485 về đo đường, phân tích và cải tiến
Thủ tục và hồ sơ để phân tích số liệu (mục 8.4)
Thủ tục và hồ sơ cho hành động khắc phục (khoản 8.5.2)
Thủ tục và hồ sơ về hành động phòng ngừa (mục 8.5.3)
Ngoài các quy trình iso 13485 cần thiết, bạn cần phải áp dụng các quy trình này trong vòng 3 tháng trước khi đánh giá chứng nhận bởi GOODVN
Nếu bạn là một doanh nghiệp, tổ chức đang hoạt động trong lĩnh vực y tế, trang thiết bị y tế và có nhu cầu được cấp chứng chỉ ISO 13485 để nâng cao chất lượng sản phẩm, khả năng cạnh tranh và mở rộng thị phần, tăng cường khả năng hợp tác trên phạm vi Quốc tế, hãy liên hệ với chúng tôi!
GỌI NGAY: 0945.001.005 – 0963.831.555 – 02466.82.0505
CHÚNG TÔI Ở ĐÂY ĐỂ PHỤC VỤ BẠN !
VĂN PHÒNG CHỨNG NHẬN QUỐC GIA – GOOD VIỆT NAM






Trả lời